研究人員倡社會提高關注罕見原發性免疫缺陷病
研究背景:至今,已知約有500種原發性免疫缺陷病,隨著新疾病的出現,這一列表每年還在不斷增長。儘管個別罕見疾病的人數稀少,但原發性免疫缺陷病的整體發病率估計為每一萬人中有一人 [1]。香港大學李嘉誠醫學院及幹細胞轉化研究中心的研究團隊最近研發了全球首個幹細胞新模型,並應用於個人化治療罕見免疫缺陷病,成功為患者提供新的治療選擇。這項突破性研究成果已發表在《過敏及臨床免疫學期刊》。
- Front Immunol. 2021 Feb 18:11:625753. doi: 10.3389/fimmu.2020.625753.
幹細胞轉化研究為罕見疾病患者帶來希望
原發性免疫缺陷病亦稱為「先天性免疫異常」」(IEI),泛指多種損害免疫系統的疾病。這些免疫缺陷屬罕見疾病,患者常面對診斷不足,加上大眾對其認知有限,為治療帶來重大挑戰。IEI患者極易受感染,缺乏對自身免疫疾病甚至癌症的抵禦能力 [1]。 儘管個別IEI病例在個人層面很罕見,但整體上,IEI 確實會導致各種嚴重疾病,甚至危及生命。因此,開展對這些相對較罕見疾病的醫學研究十分重要。這些研究有助於加深我們對IEI複雜發病機制的理解,改善診斷技術,從而為不同患者提供個人化治療。
其中一種稱為『轉錄訊息傳遞及活化子蛋白(STAT1)功能增強症(GoF)』的 IEI於 2011 年首次在文獻中記錄,並稱為常染色體顯性遺傳慢性皮膚黏膜念珠菌病(CMC)[2]。這種疾病臨床表型多樣,即使來自同一家庭的患者,遺傳了相同的突變因子,但病徵和嚴重程度亦會出現差異 [3,4,5]。 這些差異可能是由於不同STAT1-GoF潛在突變機制所致。然而,由於新病例的樣本有限,研究和確認個別突變功能極具挑戰性。因此,我們需要建立可以模擬 STAT1-GoF患者特異性和突變特異性的疾病模型,以減少重複採集患者樣本的需要。
傳統上,許多IEI(包括 STAT1-GoF)的治療均採用抗菌藥物抑制和免疫抑制來控制自體免疫症狀。然而,這些治療通常會帶來許多副作用和不良反應。 另一方面,造血幹細胞移植對STAT1-GoF 雖有治癒潛力,但失敗率卻很高 [6]。近期,Janus 活化激酶(JAK)抑制劑(JAKi)在治療 STAT1-GoF 方面顯示出良好效果,但由於STAT1-GoF 的複雜病理及生理機制和患者的異質性,不同患者可能會對不同的JAKi 產生不一樣的反應,這些往往取決於其潛在的發病機制 [7,8]。現況強調了醫學界需要建立體外和針對患者特異性的測試平台,以評估新療法的療效。
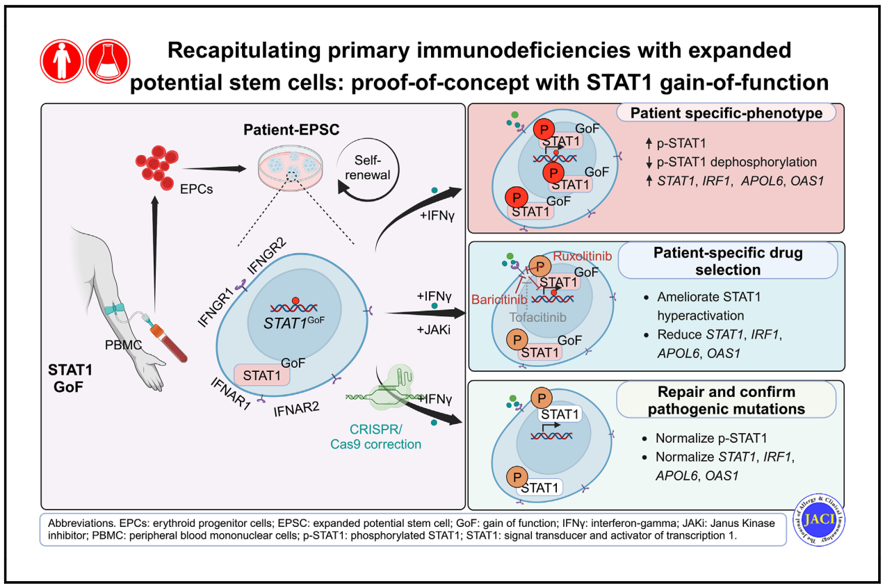
在這項研究中,我們探索了患者來源的擴展潛能幹細胞(EPSC)作為疾病模型和個人化治療的體外平台之潛力。我們建立了分別來自個別 STAT1-GoF 患者和健康對照組人士的 EPSC 細胞株。EPSC 是一種具有擴展潛能的強效幹細胞,可從體細胞重新編程獲得。同時,EPSC對所有細胞譜系均具卓越的分化潛能,並表現出高增殖率,以及更佳的遺傳和表觀遺傳穩定性。這些特性使 EPSC 成為理想的人類疾病模型和基因編輯平台 [11]。
我們成功地從紅系祖細胞中重新編程出STAT1-GoF EPSC,並在關鍵多能標記基因表達上,與對照組產生可比擬的水平。此外,功能測試顯示在 IFN-γ 的刺激下,STAT1-GoF EPSC 中的磷酸化 STAT1 (p-STAT1) 蛋白增加。同時,STAT1 及其下游基因蛋白的表達亦相應上升。這證明來自患者的 EPSC 能夠重現STAT1-GoF患者的功能異常情況。
我們進一步研究了在不同患者來源的EPSC 刺激過程中,特定 JAKi 的差異效應。結果顯示,各種 STAT1-GoF EPSC 對不同的 JAKi 均有不一樣的患者特異性反應。其中,蘆可替尼和巴瑞克替尼以劑量依賴的方式抑制 STAT1-GoF EPSC 中的 STAT1 過度激活,而在托法替布中則未觀察到此效果。這與我們一名患者的實際病歷相符,該患者對巴瑞克替尼有反應,但對眾多的 JAK1 選擇性藥物均沒有反應, 這為開發個人化治療奠定了基礎。
此外,我們使用 CRISPR/Cas9 編輯成功修復了來自患者 EPSC 細胞株中的致病性 STAT1-GoF 突變。在這些修復的 STAT1-GoF EPSC 中 ,STAT1 磷酸化蛋白和下游基因表現均能達到功能矯正的效果。我們亦對這些修復的 EPSC 細胞株進行重複功能測試,結果顯示當細胞在 IFN-γ 刺激下, p-STAT1、STAT1 及其下游基因的表達均顯著降低。透過制定針對患者的修復工作,我們又向治療 STAT1-GoF 的個人化基因療法的目標邁出了一步。
這項研究成功地證明了我們利用患者來源的 EPSC 平台建立 IEI 疾病模型的可行性,是首個概念驗證。除了個人化疾病模型外,我們預期此平台在未來的前瞻性臨床試驗中亦能有其他嶄新用途,例如從幹細胞株中生成類器官,讓我們了解不同 STAT1 突變對特定組織或器官的差異影響,並模擬不同細胞類型之間的相互作用。同時,通過使用患者來源的類器官,篩選出針對不同病症表現的治療方法。此外,我們正在研究,將致病性突變基因引入健康的 EPSC,比較患者來源的 EPSC 和基因編輯的 EPSC,以發現其他位點的潛在調節元素或作用。總的來說,我們希望最終能將此平台擴展到其他 IEI 和罕見遺傳性疾病的治療上,並在未來造福這些缺乏有效治療的患者。
參考資料:
- P.P. Lee, H. Mao, W. Yang, K.W. Chan, M.H. Ho, T.L. Lee, et al. Penicillium marneffei infection and impaired IFN-gamma immunity in humans with autosomal-dominant gain-of-phosphorylation STAT1 mutations J Allergy Clin Immunol, 133 (2014), pp. 894-896.e5
- P.H. Li, P.P. Lee, S.L. Fung, C.S. Lau, Y.L. Lu Chronic mucocutaneous candidiasis—more than just skin deep Hong Kong Med J, 24 (2018), pp. 423-425
- S. Giovannozzi, V. Lemmens, J. Hendrix, R. Gijsbers, R. Schrijvers Live cell imaging demonstrates multiple routes toward a STAT1 gain-of-function phenotype Front Immunol, 11 (2020), p. 1114
- S. Giovannozzi, J. Demeulemeester, R. Schrijvers, R. Gijsbers Transcriptional profiling of STAT1 gain-of-function reveals common and mutation-specific fingerprints Front Immunol, 12 (2021), Article 632997
- J. Zheng, F.L. van de Veerdonk, K.L. Crossland, S.P. Smeekens, C.M. Chan, T. Al Shehri, et al. Gain-of-function STAT1 mutations impair STAT3 activity in patients with chronic mucocutaneous candidiasis (CMC) Eur J Immunol, 45 (2015), pp. 2834-2846
- J.W. Leiding, S. Okada, D. Hagin, M. Abinun, A. Shcherbina, D.N. Balashov, et al. Hematopoietic stem cell transplantation in patients with gain-of-function signal transducer and activator of transcription 1 mutations J Allergy Clin Immunol, 141 (2018), pp. 704-717.e5
- R. Mossner, N. Diering, O. Bader, S. Forkel, T. Overbeck, U. Gross, et al. Ruxolitinib induces interleukin 17 and ameliorates chronic mucocutaneous candidiasis caused by STAT1 gain-of-function mutation Clin Infect Dis, 62 (2016), pp. 951-953
- O. Zimmerman, B. Rosler, C.S. Zerbe, L.B. Rosen, A.P. Hsu, G. Uzel, et al. Risks of ruxolitinib in STAT1 gain-of-function-associated severe fungal disease Open Forum Infect Dis, 4 (2017), p. ofx202
- X Liu, VSF Chan, KGC Smith, C Ming, CS Or, FTW Tsui, et al. Recapitulating primary immunodeficiencies with expanded potential stem cells: Proof of concept with STAT1 gain of function J Allergy Clin Immunol, 4 (2024), pp. 1125-1139.
- X. Gao, M. Nowak-Imialek, X. Chen, D. Chen, D. Herrmann, D. Ruan, et al. Establishment of porcine and human expanded potential stem cells Nat Cell Biol, 21 (2019), pp. 687-699
- Y. Yang, B. Liu, J. Xu, J. Wang, J. Wu, C. Shi, et al. Derivation of pluripotent stem cells with in vivo embryonic and extraembryonic potency Cell, 169 (2017), pp. 243-257.e25
作者:
幹細胞轉化研究中心首席研究員李曦教授
幹細胞轉化研究中心博士後研究員劉雪燕博士
幹細胞轉化研究中心項目總監劉澤星教授
幹細胞轉化研究中心總監劉澎濤教授
2024年9月