研究人员倡社会提高关注罕见原发性免疫缺陷病
研究背景:至今,已知约有500种原发性免疫缺陷病,随著新疾病的出现,这一列表每年还在不断增长。尽管个别罕见疾病的人数稀少,但原发性免疫缺陷病的整体发病率估计为每一万人中有一人 [1]。香港大学李嘉诚医学院及干细胞转化研究中心的研究团队最近研发了全球首个干细胞新模型,并应用于个人化治疗罕见免疫缺陷病,成功为患者提供新的治疗选择。这项突破性研究成果已发表在《过敏及临床免疫学期刊》。
- Front Immunol. 2021 Feb 18:11:625753. doi: 10.3389/fimmu.2020.625753.
干细胞转化研究为罕见疾病患者带来希望
原发性免疫缺陷病亦称为「先天性免疫异常」」(IEI),泛指多种损害免疫系统的疾病。这些免疫缺陷属罕见疾病,患者常面对诊断不足,加上大众对其认知有限,为治疗带来重大挑战。IEI患者极易受感染,缺乏对自身免疫疾病甚至癌症的抵御能力 [1]。 尽管个别IEI病例在个人层面很罕见,但整体上,IEI 确实会导致各种严重疾病,甚至危及生命。因此,开展对这些相对较罕见疾病的医学研究十分重要。这些研究有助于加深我们对IEI复杂发病机制的理解,改善诊断技术,从而为不同患者提供个人化治疗。
其中一种称为『转录讯息传递及活化子蛋白(STAT1)功能增强症(GoF)』的 IEI于 2011 年首次在文献中记录,并称为常染色体显性遗传慢性皮肤黏膜念珠菌病(CMC)[2]。这种疾病临床表型多样,即使来自同一家庭的患者,遗传了相同的突变因子,但病征和严重程度亦会出现差异 [3,4,5]。 这些差异可能是由于不同STAT1-GoF潜在突变机制所致。然而,由于新病例的样本有限,研究和确认个别突变功能极具挑战性。因此,我们需要建立可以模拟 STAT1-GoF患者特异性和突变特异性的疾病模型,以减少重复采集患者样本的需要。
传统上,许多IEI(包括 STAT1-GoF)的治疗均采用抗菌药物抑制和免疫抑制来控制自体免疫症状。然而,这些治疗通常会带来许多副作用和不良反应。 另一方面,造血干细胞移植对STAT1-GoF 虽有治愈潜力,但失败率却很高 [6]。近期,Janus 活化激酶(JAK)抑制剂(JAKi)在治疗 STAT1-GoF 方面显示出良好效果,但由于STAT1-GoF 的复杂病理及生理机制和患者的异质性,不同患者可能会对不同的JAKi 产生不一样的反应,这些往往取决于其潜在的发病机制 [7,8]。现况强调了医学界需要建立体外和针对患者特异性的测试平台,以评估新疗法的疗效。
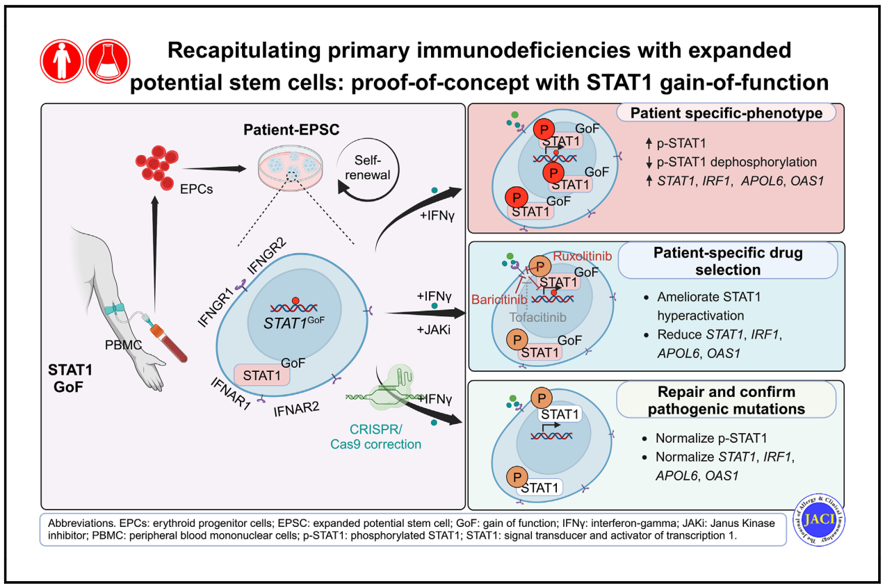
在这项研究中,我们探索了患者来源的扩展潜能干细胞(EPSC)作为疾病模型和个人化治疗的体外平台之潜力。我们建立了分别来自个别 STAT1-GoF 患者和健康对照组人士的 EPSC 细胞株。EPSC 是一种具有扩展潜能的强效干细胞,可从体细胞重新编程获得。同时,EPSC对所有细胞谱系均具卓越的分化潜能,并表现出高增殖率,以及更佳的遗传和表观遗传稳定性。这些特性使 EPSC 成为理想的人类疾病模型和基因编辑平台 [11]。
我们成功地从红系祖细胞中重新编程出STAT1-GoF EPSC,并在关键多能标记基因表达上,与对照组产生可比拟的水平。此外,功能测试显示在 IFN-γ 的刺激下,STAT1-GoF EPSC 中的磷酸化 STAT1 (p-STAT1) 蛋白增加。同时,STAT1 及其下游基因蛋白的表达亦相应上升。这证明来自患者的 EPSC 能够重现STAT1-GoF患者的功能异常情况。
我们进一步研究了在不同患者来源的EPSC 刺激过程中,特定 JAKi 的差异效应。结果显示,各种 STAT1-GoF EPSC 对不同的 JAKi 均有不一样的患者特异性反应。其中,芦可替尼和巴瑞克替尼以剂量依赖的方式抑制 STAT1-GoF EPSC 中的 STAT1 过度激活,而在托法替布中则未观察到此效果。这与我们一名患者的实际病历相符,该患者对巴瑞克替尼有反应,但对众多的 JAK1 选择性药物均没有反应, 这为开发个人化治疗奠定了基础。
此外,我们使用 CRISPR/Cas9 编辑成功修复了来自患者 EPSC 细胞株中的致病性 STAT1-GoF 突变。在这些修复的 STAT1-GoF EPSC 中 ,STAT1 磷酸化蛋白和下游基因表现均能达到功能矫正的效果。我们亦对这些修复的 EPSC 细胞株进行重复功能测试,结果显示当细胞在 IFN-γ 刺激下, p-STAT1、STAT1 及其下游基因的表达均显著降低。透过制定针对患者的修复工作,我们又向治疗 STAT1-GoF 的个人化基因疗法的目标迈出了一步。
这项研究成功地证明了我们利用患者来源的 EPSC 平台建立 IEI 疾病模型的可行性,是首个概念验证。除了个人化疾病模型外,我们预期此平台在未来的前瞻性临床试验中亦能有其他崭新用途,例如从干细胞株中生成类器官,让我们了解不同 STAT1 突变对特定组织或器官的差异影响,并模拟不同细胞类型之间的相互作用。同时,通过使用患者来源的类器官,筛选出针对不同病症表现的治疗方法。此外,我们正在研究,将致病性突变基因引入健康的 EPSC,比较患者来源的 EPSC 和基因编辑的 EPSC,以发现其他位点的潜在调节元素或作用。总的来说,我们希望最终能将此平台扩展到其他 IEI 和罕见遗传性疾病的治疗上,并在未来造福这些缺乏有效治疗的患者。
参考资料:
- P.P. Lee, H. Mao, W. Yang, K.W. Chan, M.H. Ho, T.L. Lee, et al. Penicillium marneffei infection and impaired IFN-gamma immunity in humans with autosomal-dominant gain-of-phosphorylation STAT1 mutations J Allergy Clin Immunol, 133 (2014), pp. 894-896.e5
- P.H. Li, P.P. Lee, S.L. Fung, C.S. Lau, Y.L. Lu Chronic mucocutaneous candidiasis—more than just skin deep Hong Kong Med J, 24 (2018), pp. 423-425
- S. Giovannozzi, V. Lemmens, J. Hendrix, R. Gijsbers, R. Schrijvers Live cell imaging demonstrates multiple routes toward a STAT1 gain-of-function phenotype Front Immunol, 11 (2020), p. 1114
- S. Giovannozzi, J. Demeulemeester, R. Schrijvers, R. Gijsbers Transcriptional profiling of STAT1 gain-of-function reveals common and mutation-specific fingerprints Front Immunol, 12 (2021), Article 632997
- J. Zheng, F.L. van de Veerdonk, K.L. Crossland, S.P. Smeekens, C.M. Chan, T. Al Shehri, et al. Gain-of-function STAT1 mutations impair STAT3 activity in patients with chronic mucocutaneous candidiasis (CMC) Eur J Immunol, 45 (2015), pp. 2834-2846
- J.W. Leiding, S. Okada, D. Hagin, M. Abinun, A. Shcherbina, D.N. Balashov, et al. Hematopoietic stem cell transplantation in patients with gain-of-function signal transducer and activator of transcription 1 mutations J Allergy Clin Immunol, 141 (2018), pp. 704-717.e5
- R. Mossner, N. Diering, O. Bader, S. Forkel, T. Overbeck, U. Gross, et al. Ruxolitinib induces interleukin 17 and ameliorates chronic mucocutaneous candidiasis caused by STAT1 gain-of-function mutation Clin Infect Dis, 62 (2016), pp. 951-953
- O. Zimmerman, B. Rosler, C.S. Zerbe, L.B. Rosen, A.P. Hsu, G. Uzel, et al. Risks of ruxolitinib in STAT1 gain-of-function-associated severe fungal disease Open Forum Infect Dis, 4 (2017), p. ofx202
- X Liu, VSF Chan, KGC Smith, C Ming, CS Or, FTW Tsui, et al. Recapitulating primary immunodeficiencies with expanded potential stem cells: Proof of concept with STAT1 gain of function J Allergy Clin Immunol, 4 (2024), pp. 1125-1139.
- X. Gao, M. Nowak-Imialek, X. Chen, D. Chen, D. Herrmann, D. Ruan, et al. Establishment of porcine and human expanded potential stem cells Nat Cell Biol, 21 (2019), pp. 687-699
- Y. Yang, B. Liu, J. Xu, J. Wang, J. Wu, C. Shi, et al. Derivation of pluripotent stem cells with in vivo embryonic and extraembryonic potency Cell, 169 (2017), pp. 243-257.e25
作者:
干细胞转化研究中心首席研究员李曦教授
干细胞转化研究中心博士后研究员刘雪燕博士
干细胞转化研究中心项目总监刘泽星教授
干细胞转化研究中心总监刘澎涛教授
2024年9月