前言
「老化」是个神秘的过程,而且引发了我们许多疑问。为何生物会老化?为何我们死亡的年龄又各有不同?老化背后又蕴藏著什么机制?科学家观察到,一组实验室小鼠即使基因相同,每只寿命却各有不同,令人啧啧称奇。当生物老化时,细胞功能失常的情况会增加,影响正常组织功能,导致与年龄相关的疾病形成,如癌症、神经退化性疾病、心血管疾病 (CVD)。全球人类平均预期寿命大幅提高,部分原因来自治疗、诊断和医疗体系的进步。随著人类寿命延长,对老年人的照顾亦加重了医疗体系的负担,皆因老化会伴随著很多与年龄相关的缺陷或问题;另外,劳动人口老化亦导致生产力降低的问题。老年人的共同特征是越接近八十岁,衰弱会越变得明显,以及容易罹患脑退化症。为何老化会离不开这些缺陷?人类有没有办法跨越这些缺陷,甚至迈向长生不老?
我们目前对老化的大部分理解都来自对动物及单细胞模型所作过的研究,例如实验室小鼠、线虫(即秀丽隐杆线虫,学名Caenorhabditis elegans,简称C.elegans)及酵母(即酿酒酵母,学名Saccharomyces cerevisiae,简称S.cerevisiae)。尽管已有大量对老化的研究,但我们对此的理解仍然有限,因为这些动物模型只模拟了老化某些方面的特征,所以我们对上述问题仍然是无从入手。希望本文能引领读者了解「时间上」的老化与「生物上」的老化概念有何不同︰前者是指由出生至某个日期所经过的时间长度;后者是指生物体的细胞逐渐累积不可逆转的损伤(例如 DNA、蛋白质、脂质等大分子)。本文会从某些老化的特征探讨生物老化,以及我们可以透过什么途径减慢衰老,从而活出长寿而丰富的人生。
老化的迹象
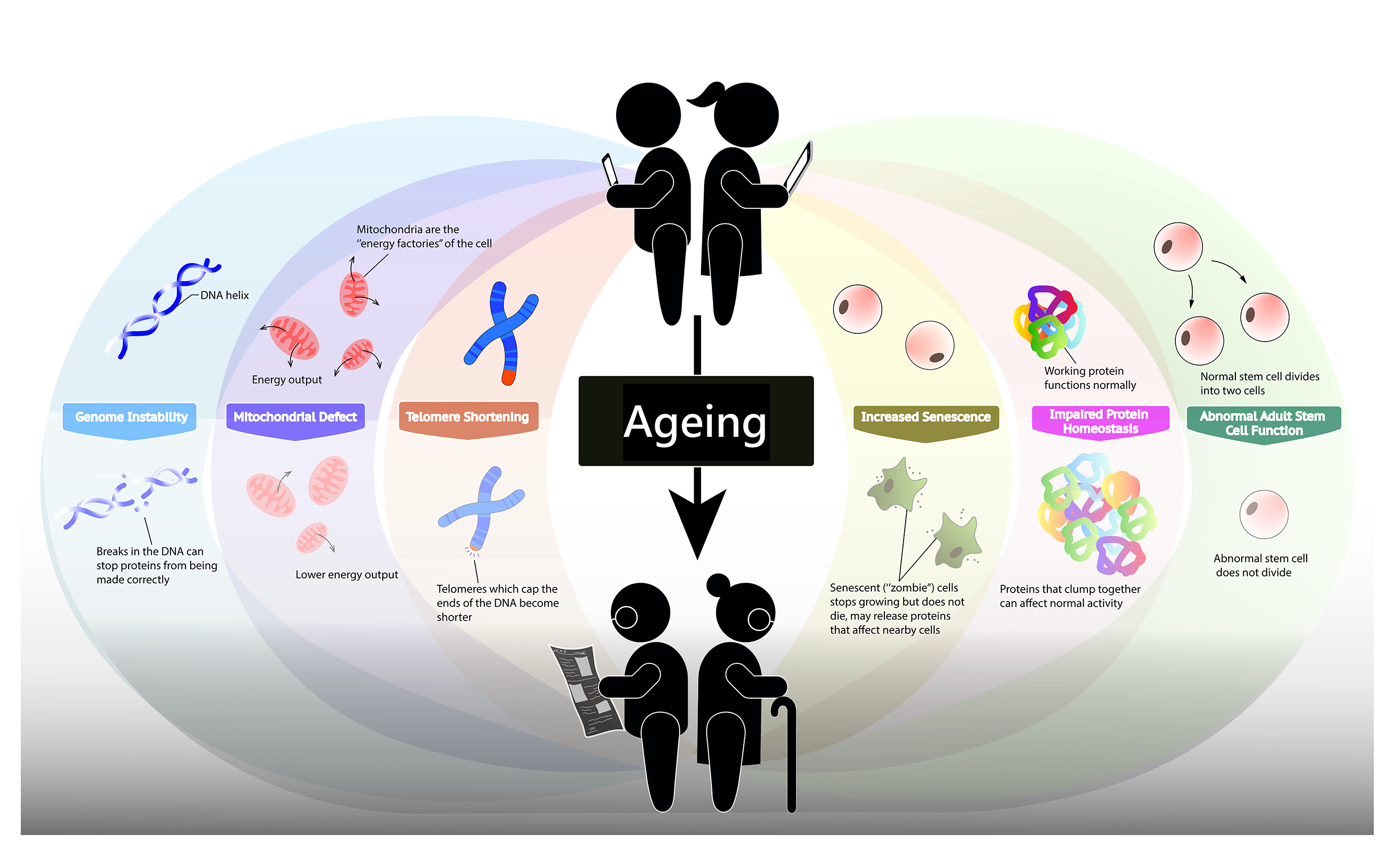
遗传不稳定性
老化与生物在一生里积累的遗传物质损伤有密切关系。在细胞分裂过程中,细胞机器会复制细胞基因组,然而这个过程容易出错,因而导致基因突变发生以及更多活性氧类 (ROS)的产生,与化学物质(例如紫外线辐射)接触亦可能引致 DNA 损伤。根据 DNA 损伤的类型,细胞可透过启动细胞周期检查点(checkpoint)来作出反应,从而暂停细胞周期,让细胞有时间进行 DNA 修复,并在有需要时启动分解蛋白质的一连串化学反应。细胞具有多条DNA 修复路径,这对保持细胞基因组完整至关重要,并且被认为在维持寿命方面发挥了重要作用。事实上,DNA 修复过程中的几种遗传缺陷正是与几种早衰症有关。
某几种早衰症亦是由于 DNA 损伤累积而发生,然而它们只能解释老化过程的某些层面。这些遗传异常情况各有不同,它们的位置会影响重要基因的功能,导致细胞功能失常。如果这些功能失常的细胞不能透过细胞凋亡或衰老(参阅下文有关衰老的部分)被清除,它们的存在就可能会干扰组织的稳定状态(homeostasis),导致疾病出现,例如癌症。
粒线体功能的变化
粒线体是以ATP形式产生能量供细胞执行日常功能的主要细胞器官。它们具有遗传自母亲的 DNA,进行ATP合成作用时亦会产生活性氧类 (ROS) 作为副产物。粒线体 DNA (mtDNA) 容易出现与衰老相关的突变,部分原因是活性氧类的释放以及缺乏组蛋白保护 DNA 免受损伤。此外,粒线体中DNA 修复路径的效能亦会低于细胞核中的路径。这些突变更常在年老细胞中出现,并会影响呼吸链复合物的功能(其功能是在不同组织中产生 ATP)。当小鼠因为突变而缺少一种粒线体酶时(其功能是复制粒线体 DNA,mtDNA),会出现过早衰老及寿命缩短。科学家在老化人类的心脏、大脑和肌肉中也发现 mtDNA 缺失,进一步证明了维持 mtDNA 的稳定是决定老化能否健康正常的关键。
呼吸链蛋白的功效会随著老化而下降,导致电子的泄漏增加以及 ATP 的产量减少。功能失常的粒线体可能会受到其薄膜稳定性及粒线体动态变化的影响。细胞可以透过粒线体自噬(即粒线体被囊泡「吞噬」并分解)来去除有缺陷的粒线体。粒线体自噬功能的缺陷往往与阿兹海默症 (AD) 及其他神经退化性疾病有关。研究亦发现,端粒的维护有助促进粒线体自噬。当小鼠缺乏端粒酶,粒线体的数量及生长亦降低,从而影响细胞中粒线体的正常功能。当研究人员激活端粒之后,粒线体衰退得到部分逆转。科学家们指出,老化过程中逐渐出现的粒线体功能失常或会增加 ROS 水平(ROS 会降低细胞器正常运作的能力)。然而他们又发现,ROS 的增加亦延长了寿命,而提高抗氧化物亦无助于延长动物的寿命,与上述理论有冲突。但无论如何,粒线体功能失常已肯定是老化迹象之一。
端粒长度
如前面所述,DNA 损伤的增加与年龄有关,其端粒(位于染色体末端)会变得非常脆弱。DNA 损伤可能导致细胞凋亡或衰老。复制酶亦无法完全复制端粒,这只能依赖端粒酶的活性。然而,多数哺乳类动物的细胞并没有端粒酶,以致端粒逐渐缩短。而且,这些位置的 DNA 修复亦受到很大的限制,因为它们一般都结合了蛋白质,以免端粒在正常情况下被当作受损的 DNA。研究发现,端粒的缺陷与人类疾病的早期发展有关。缺乏端粒酶的动物模型寿命较短;当启动端粒酶后,寿命则会延长。另外需要留意的是,最近一项对癌症相关突变的研究发现,长端粒似乎会增加人类患癌的风险。端粒缩短虽然与早衰老有关,但亦有助预防癌症,因为它可以阻止细胞分裂。总而言之,端粒长度并非量度细胞年龄的可靠标准。
衰老
衰老是指不可逆转地离开细胞周期的状态,或会随细胞应激(cellular stress)而发生。要辨认衰老细胞,可借助一组由衰老细胞分泌的蛋白质,称为「衰老相关分泌表型」(senescence-associated secretory phenotype,SASP)。 这类分泌出来的因子,如生长因子、炎性细胞因子和酶,可影响邻近细胞的生长。这些细胞可以被识别,是因为它们所呈现已知蛋白质的量与CVD 及 AD等衰老相关疾病所表现的相当。若在显示衰老迹象的早衰动物模型中去除这些蛋白质,可以改善受影响细胞的状态。由于在老化过程中衰老会加剧,因此衰老被认为会导致老化。然而,从小鼠身上又见到,当衰老相关蛋白质小幅度增加时,寿命会延长。这项观察显示,这些蛋白质的初期累积可能是细胞的反应方式之一,但过度的衰老又反而会减弱细胞功能。
蛋白质稳定状态的问题
我们已肯定老化与蛋白质稳定状态受损有关。稳定状态是指细胞透过一系列品质控制(QC)路径来维持细胞环境稳定的能力,借此确保蛋白质折叠正确以及功能失常的蛋白质能充分地被移除。在蠕虫和苍蝇中,这些 QC 相关蛋白的高水平导致了寿命延长。蛋白质要正常发挥作用,就必须折叠正确,而在苛刻的条件下,蛋白质会发生聚集。研究发现,错误折叠的蛋白质与老化相关疾病有关,例如 AD 及帕金逊症。
自噬-溶酶体路径对维持蛋白质稳定状态亦很重要。这个「自我吞食」的过程能透过将目标与含有消化酶的囊泡融合来将内容物降解,从而将细胞中功能失常或不必要的细胞成分去除。然而,自噬会随著年龄减慢,这被认为与神经退化性疾病及癌症有关联。使用药物可以增加自噬,从而延长酵母及线虫的寿命,并延缓小鼠的某些老化迹象。总括而言,蛋白质丧失稳定状态是衰老相关疾病的共有特征,因此可能成为未来抗衰老治疗的目标。
成体干细胞功能
成体干细胞 (ASC) 对维持组织功能及整体健康有重要作用。它们位于特定的组织之中,例如肠道、骨髓、肝脏和骨骼肌肉。成体干细胞一般负责组织的维护及恢复,其中一部份会处于静止状态(未进入细胞周期),因此可以快速回应刺激(例如组织损伤)、启动并重新进入细胞周期。一个干细胞会分裂成两个子细胞。其中一个子细胞会被指定分化成构成该组织的多种细胞之一;另一个子细胞则会以干细胞形式返回静止状态。这个机制可保护 ASC 免于 DNA 损伤并维持常驻干细胞的数量。然而,随著年龄增长,ASC 会开始失去启动能力,因而降低组织的再生能力。此时 ASC 会出现异常的细胞分裂并无法恢复静止状态,因此会消耗干细胞库,以致某些情况下,老年生物体的干细胞比年轻生物体少。
骨髓、肝脏、脾脏的其中一组干细胞是为造血干细胞 (HSC)。HSC 是学术界已充分研究的 ASC 之一。HSC 会在造血作用(hematopoiesis)中产生血细胞(包括红血球及免疫细胞)。这个过程会随著年龄增长而减慢,导致免疫细胞及血细胞减少,最终导致免疫系统变弱、抵抗感染的能力降低,增加贫血发生率以及患癌的风险。年老囓齿动物模型中的 HSC 显示,其细胞周期活性降低及再生能力降低。
突变可以在干细胞中进行整理。白血病相关突变的研究发现,在正常血细胞身上,与白血病无关的突变普遍比预期更多。血细胞在很大程度上被认为是源自年青成人体内的一千个活跃干细胞,然而当这些血细胞之中又有许多都带有相同的突变时,可以推断在某些人的身体里这些血细胞是由单一干细胞负责演变而成的。这个现象在老年人中越来越常见,它与心血管疾病、中风、糖尿病风险增加有关。科学家在这些干细胞中发现了一些突变基因,而这些基因通常负责编码制造控制基因表达的蛋白质。模拟不同血病的小鼠模型大部份都有干细胞突变,导致干细胞无法维持。一条在正常条件下调节对压力及 DNA 损伤反应的基因普遍地在癌症中发生突变,但又控制著 HSC 细胞分裂。当缺少该基因的 HSC 被移植到其他生物体时,它们会减少细胞分裂,再生组织的能力会下降。
骨骼肌由位于肌肉纤维基底层(basal lamina)之下的肌肉干细胞(又称为卫星细胞 (SCs))组成。当受伤后,SCs 对受伤后的肌肉再生发挥主要作用。然而,由于干细胞分裂能力降低,年老肌肉的再生过程会减慢,因此干细胞分化成新肌肉纤维的速度会减慢。 SCs 亦对周围环境相当敏感,它们正常运作的能力容易受到影响。众所周知,老化的变化会改变微环境,从而导致肌肉流失。人类在老化过程中的肌肉质量及强度丧失的情形又称为少肌症,会增加跌倒、身体残疾和死亡的风险。少肌症的生物原理尚未清楚,但一般认为与多种因素有关,例如炎症、粒线体功能异常、肌肉结构丧失、干细胞数量减少。

图一:老化的迹象
老化过程的未解之谜
我们普遍认为,衰老过程是所有生物的结果,当年龄增长,死亡率就会增加。生物体能否在成年期确保功能健全,取决于体内稳定状态,因此必须予以严格调节;否则可能会导致细胞功能失常,继而出现疾病。然而,有几项重要的实验改变了我们对老化的认识。联体共生是指利用手术将两个生物体(一个年轻,一个年老)联合为一的过程,以便我们研究血液中与年龄相关及疾病相关变化。暴露于年轻环境的年老干细胞表现出较年轻的特征,可见要恢复某些年老特征是有可能;暴露于年老环境的年轻干细胞则表现出与老化相关的细胞功能缺陷,显示干细胞会深受环境影响,而释放到血液中的因子可能是逆转老化的关键。
研究人员在联体共生实验中发现几种老化相关血液因子是与炎症或免疫系统相关的蛋白质,例如是影响神经元细胞生长及分裂的细胞因子。其他蛋白质的水平亦会随年龄增加,甚至影响肌肉组织的再生。总而言之,实验反映炎症在老化过程中有某些作用。
返老还童的实验来自研究精子令卵子受精的过程;受精过程中,两个细胞会二合为一,形成一个不带有任何亲代细胞年龄痕迹的单一细胞。有较早的实验从蝌蚪的肌肉取出细胞核并转移至移除了细胞核的滑爪蟾(Xenopus)卵中,生出健康的雄性及雌性青蛙,显示细胞核被卵子的环境以某种方式重编程。从一些对年轻及年老细胞分子特征的研究可见,虽然所有细胞都携带相同的基因组 DNA,但基因转录受表观遗传学所控制,因此基因相同的细胞会成为不同类型的细胞。

图二:表观遗传学
表观遗传学是指在DNA序列不改变前提下,透过染色质、DNA、RNA、蛋白质结构的化学变化而发生的基因表达变化。DNA 是由单一核苷酸单元组成的一条长链,可利用化学方法予以修饰。科学家已清晰呈现两种化学变化:利用特定的酶将胞嘧啶甲基化(在某些核苷酸上出现)及将赖氨酸乙酰化(在组蛋白上出现),达到改变基因表达的目的。在特定基因组位置增加组蛋白的乙酰化或三甲基化,可造成我们所谓的年龄相关表观遗传学标记,而在联体共生过程中去除这些标记,可使年老细胞恢复至年轻、健康的细胞。
科学家极想了解哪些细胞路径导致基因表达控制失调,从而导致老化过程中干细胞功能下降。在无脊椎动物模型中显示,组蛋白甲基化与衰老有关,而当引致甲基化增加的基因发生缺失时,会令延长寿命的表型出现。研究亦发现,与推动基因表达的启动子(promoter)相关的一个特定组蛋白甲基化标记出现时,与寿命缩短有关联。相反,在酵母中,当其另一种组蛋白标记的水平下降时,寿命则减少。研究人员利用DNA甲基化来作老化生物标记,估计整个人类生命周期间的组织年龄。此外,在一些比较人瑞(达百岁者)与中年人的研究中,科学家发现甲基化基因会发生变化,而部分基因与疾病有关联。
有什么方法可以防止衰老?
目前市场上并无抗老化的药物可供使用,然而研究已充分证实环境因素对改善细胞健康的益处。动物模型的研究证实,卡路里限制 (CR) 可增加寿命,其部分原因是促进自噬以及脂肪的代谢,从而降低体重。可是人类始终难以维持 CR,因此营养学家提出间遏断食法 (IF),即在一日的连续八小时之内进食,在剩余十六小时之内则断食。IF 亦能改善自噬、提高葡萄糖耐受性,并帮助身体由葡萄糖转换至以酮为能源进行代谢。
有趣的是,CR亦减少了恒河猴体内的年龄相关DNA甲基化变化。因此,对处于糖尿病前期以及肥胖的人士,CR 及 IF 是有效的手段。采用某些饮食法亦有其好处,正如早有研究发现地中海饮食与长寿和预防心血管疾病及癌症有关。这种饮食法的特点是进食大量蔬菜、植物性食物、水果、鱼、橄榄油,同时提高维他命、抗氧化物、omega-3 脂肪酸的摄取量,这些营养素均有助改善细胞健康。
运动或体力活动对人体的健康亦非常有益,例如可改善心血管健康及增强骨骼肌肉。在有关肥胖的临床研究及实验模型亦显示,运动有理想的效果。在进行带氧运动的小鼠中,其组织中的自噬增加,包括骨骼肌肉、心脏、肝脏。长期运动亦使小鼠的高脂肪诱导葡萄糖耐受不良改善。运动对干细胞功能的益处亦在小鼠身上得到证明。在研究中,研究员向小鼠提供一个跑步滚轮,年老小鼠在跑步后肌肉修复加快,而其 SC 功能相比年轻干细胞亦有改善。运动亦部分逆转了老化过程中的转录变化,并缓和了年老肌肉干细胞中的一些细胞应激迹象。研究亦发现,抗阻力运动可增强肌肉质量及强度,在年轻少肌症病人身上有相同益处,显示其实可透过外部方法恢复失去的肌肉质量。
运动的其他好处包括增加粒线体的生物合成、增强骨骼肌肉中的 ATP 产量,以及促进粒线体自噬。有氧运动除了对心血管有益处外,运动亦能透过增加生长因子的分泌来促进神经元健康,从而支持已有的和新的神经元生存,并支持学习及记忆的过程。有一项对轻度认知障碍病人的试验显示,他们进行有氧运动后,海马体收缩减少、大脑功能改善,记忆力提升。
总结
现时全球的老年人口比例越来越高,特别是在医疗保健及社会服务较佳的发达国家。人类死亡的主要原因是老年患病,因为通常老人对疾病感染的抵抗能力较低,而且身心健康状况较差。然而,有些老人仍然生活得很有活力,而且长命百岁。难道延缓衰老的秘密就藏在这少数人身上?我们所知的是环境因素,例如生活方式,可以影响细胞正常运作的能力,以及可能在一定的基因层面上减缓老化的表现。然而,我们对于老化的生物学理解仍然有很多不明之处,这点会更加激发科学家研究老化,务求最终能研发出令人类即使变老亦能改善健康质素并得享长寿的方法。
术语解释
癌症:一组涉及不受控制的细胞生长,并会形成肿瘤的疾病。
神经退化性疾病:一组涉及神经细胞死亡或功能异常的疾病。
心血管疾病 (CVD):涉及心脏或血管功能异常的疾病。
衰弱:体质虚弱,老化的常见征状。
脑退化症:泛指丧失记忆或其他脑功能,使日常生活受影响。
基因突变:DNA序列发生变化。
活性氧类 (ROS):不稳定的含氧分子,可与 DNA、RNA 或蛋白质起反应,造成损害。
细胞凋亡:一个导致细胞死亡的有序过程,描述了组织如何去除癌细胞或功能失常的细胞。
衰老:细胞开始功能衰退并停止分裂的不可逆转状态。
ATP:三磷酸腺苷,一种供细胞用作执行日常功能的能量携带分子。
组蛋白:包在 DNA 里的蛋白质,一般会保护 DNA 免受损伤。
阿兹海默症 (AD)︰俗称老人痴呆症,一种无法治愈的脑部疾病,成因是神经元死亡或功能异常,影响记忆及思维能力。
粒线体自噬:通过降解方式去除细胞内受损粒线体的过程。
囊泡:携带细胞物质的细胞之内/外部结构。
抗氧化物:抗衡 ROS 的化学物质,又称为「自由基清道夫」,通常具保护作用。
端粒酶:维持端粒稳定的酶。
端粒:位于 DNA 的末端,保护 DNA 不与其他 DNA 融合。
帕金逊症 (PD):脑疾病,成因是神经元死亡或功能失常,导致颤抖、僵硬及行动困难。
自噬:细胞去除不需要或机能失调成分的自然过程,又称为「自食」。
分化:细胞由某种类型变成另一种类型。
静止:细胞处于如非必要不会分裂的可逆转状态,见于成体干细胞(非休眠状态)。
白血病:一种白细胞癌症。
中风:流向大脑的血因为出血或血管受阻而被隔断,导致细胞死亡。
糖尿病:血糖维持高水平的疾病,导致血液里的血糖积聚。
少肌症:骨骼肌肉质量及强度会缓慢丧失的疾病,多见于老人。
联体共生:实验方法,将两个生物体连至一套共同生理系统(例如筋膜、供血系统)。
炎症:身体组织对有害刺激(如感染、组织损伤)的生物反应。
细胞因子:炎症时细胞释出的一大组蛋白质,作用是向其他细胞发出信号。
表观遗传学:对DNA序列不改变前提下,基因表达变化的研究。
甲基化:将-CH3 基团添加至化合物中的化学过程。当添加至 DNA 或组蛋白时,会控制基因表达。
乙酰化:将-OOH基团添加至化合物中的化学过程。当添加至组蛋白时,会控制基因表达。
赖氨酸:碱性氨基酸,是蛋白质的组成部分。
核苷酸:DNA 和 RNA 的组成部分。
胞嘧啶:构成 RNA 和 DNA 的四种化学碱基之一。
生物标记:反映可能有疾病迹象的可测量的变量。
卡路里限制 (CR):减少食物摄取量至低于每日卡路里摄取量。
酮:脂肪酸分解后释放的分子,可在禁食或剧烈运动后释出。
轻度认知障碍 (MCI):泛指思维能力持续丧失的大脑状况,会增加晚年患上 AD 的风险。
作者简介
张晓东教授现为香港科技大学(HKUST)生命科学部的何善衡生命科学副教授。张教授在美国科罗拉多大学获得生物化学博士学位。他的研究专长是干细胞及老化生物学,曾利用实验室老鼠的肌肉干细胞发现干细胞静止及组织再生的关键分子路径。张教授亦因「干细胞衰老过程中的分子控制」研究获得 2015 年裘槎前瞻科研大奖,并曾在著名期刊发表超过三十篇科学论文。此外,张教授亦担任香港科技大学 – 南丰集团联合实验室主任、生物科学实验中心副主任、香港科技大学 – 华大基因联合研究中心主任、香港科技大学 – 上海第六人民医院脑科学联合研究中心副主任,以及位于香港科学园的香港神经退行性疾病中心 (HKCeND) 的主要成员。
Erin Tse博士在英国阿斯顿大学获得生物医学科学博士学位,在 Eric Hill 博士的指导下研究阿兹海默症。谢博士为求有更高发展而移居香港,从事微生物学研究,随后加入病毒学小组一段时间,利用由人类干细胞衍生的类肠道组织研究人类诺沃克病毒结构蛋白的宿主互作。谢博士凭借其学术经验,专门从事细胞生物学的研究。谢博士目前是张教授实验室的博士后研究员,并将在此继续其干细胞研究。谢博士亦是香港科技大学 – 南丰集团联合实验室的活跃成员,主要负责管理联合实验室的活动及指导学员。
2022年3月